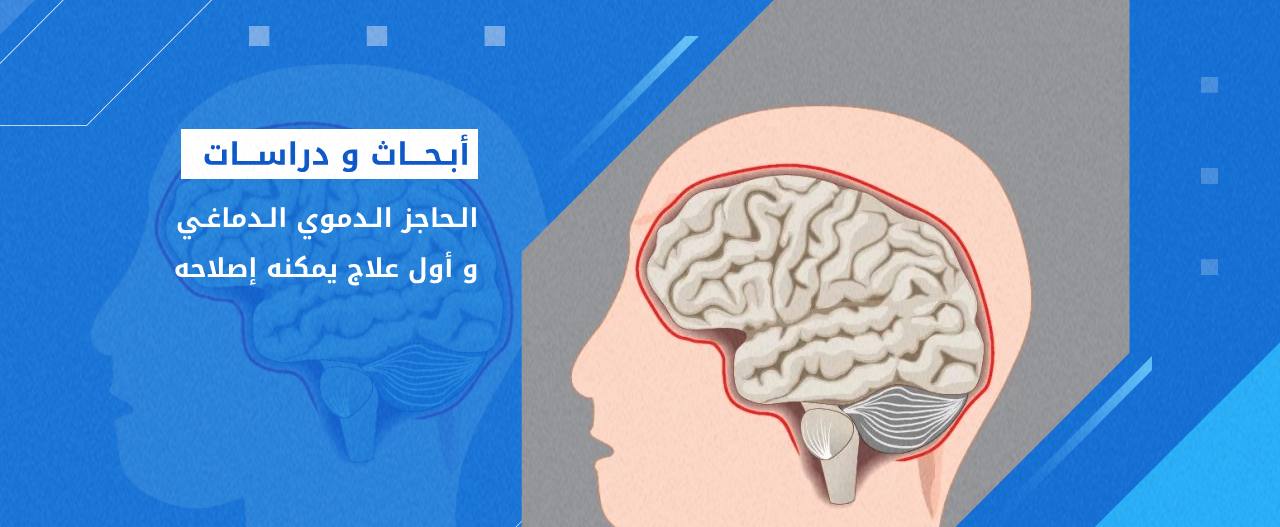
تجربة أول علاج محتمل لإصلاح الحاجز الدموي الدماغي تم تجريبه على الفئران.
في خطوة مثيرة، قام العلماء بتطوير أول علاج محتمل يمكنه إصلاح الحاجز الدموي الدماغي في الفئران.
لم يتم اختبار العلاج الجديد على البشر حتى الآن، لذا يجب أن لا نتسرع في الاستنتاجات. ولكن إيجاد طريقة لوقف تسرب المسببات المرضية والسموم إلى خلايا الدماغ قد يغير طريقة علاجنا والوقاية من الأمراض بما في ذلك السكتة الدماغية والسرطان وكوفيد ومرض الزهايمر.
الحاجز الدموي الدماغي: هو طبقة من الخلايا تحيط بالأوعية الدموية التي تغذي أدمغتنا. يفترض أن يكون مانعًا قابلا للاختيارية، مما يعني أنه يسمح فقط بمرور المواد الضرورية للحفاظ على وظائف الدماغ الصحية إلى أنسجة الدماغ.
ولكن عندما لا تعمل الأمور بشكل صحيح، يمكن أن تتجاوز السموم والخلايا غير المرغوب فيها أو المسببات الحاجز. يمكن لخلايا السرطان التي تتجاوز الحاجز أن تتحول إلى أورام. حيث أظهرت دراسات أن فيروس SARS-CoV-2 قادر على اختراق الحاجز وتسبب الارتباك العقلي. ويمكن أن يؤدي انتشار الكثير من خلايا الدم البيضاء عبر الحاجز إلى حدوث حالات مناعية ذاتية مثل التصلب المتعدد. وهذا فقط لذكر بعض المضاعفات.
من الصعب بما فيه الكفاية إيصال الأدوية من خلال حاجز الدماغ الدموي. ولكن إيجاد طريقة لوقف هذا التسرب شيء يفوق قدرة العلماء – حتى الآن.
يقول أخصائي الأمراض الدموية كالفن كو من جامعة ستانفورد، الذي قاد البحث: “تسرب الحاجز الدموي الدماغي هو المسار الشائع للعديد من أمراض الدماغ، لذا أن تكون قادرًا على إغلاق الحاجز هو هدف طالما سعيت إليه في مجال الطب”.
“لقد قمنا بتقييم فئة جديدة من الجزيئات العلاجية يمكن استخدامها لعلاج تسرب حاجز الدماغ الدموي؛ حيث لم تكن هناك مسبقًا علاجات موجهة نحو الحاجز الدموي الدماغي بشكل خاص.”
يتمحور عمل الباحثين حول عائلة من المستقبلات المسماة “فريزلد”. هذه البروتينات تبدأ مسار إشارة الـ Wnt، والذي ليس فقط مشتركًا في تعزيز تجدد الأنسجة وشفاء الجروح، بل يلعب أيضًا دورًا هامًا في الحفاظ على صحة الحاجز الدموي الدماغي.
أظهرت الأبحاث السابقة على الفئران أن التغيرات الجينية في جين فريزلد يمكن أن تسبب مشاكل في حاجز الدماغ الدموي، وخصوصًا في أحد المستقبلات الفريزلد المعروفة بـ FZD4.
استنادًا إلى هذا العمل، تعاون فريق ستانفورد مع شركة بحثية لإنشاء جزيء يُسمى L6-F4-2 يرتبط بـ FZD4 لتفعيل مسار الـ Wnt. في الواقع، يُفعل مسار الـ Wnt بكفاءة تزيد 100 مرة عن غيره من الجزيئات المعروفة التي تترابط مع FZD4.
لمزيد من اختبار العلاج الجديد المحتمل، نظر الباحثون إلى الفئران التي تحمل طفرات جينية تؤدي إلى حالة مشابهة لمرض نوري(Norrie). تحول هذا التغير الجيني دون قدرة الفئران على إنتاج البروتين نورين الذي يرتبط بـ FZD4.
تعاني الفئران بدون نورين من العمى بسبب مشاكل في حاجز الدم الشبكي في العين، والذي يعمل بطريقة مشابهة للحاجز الدموي الدماغي.ومع ذلك، عندما قام الفريق بحقن إحدى عيني الفئران بـ L6-F4-2 عند الولادة، كانت الأوعية الدموية حول الشبكية أكثر كثافة وأقل تسربًا مقارنة بالعين التي لم يتم علاجها.
أظهرت الدراسات الإضافية على فئران أكبر سنًا أن L6-F4-2 نجح في تنشيط إشارات الـ Wnt بنجاح في كل من الشبكية والمخيخ. ثم قام الباحثون بدراسة حالة أكثر شيوعًا – السكتة الدماغية الناجمة عن انسداد الأوعية الدموية وتضررالحاجز الدموي الدماغي.
أظهرت نتائج إعطاء L6-F4-2 للفئران التي تعاني من سكتات دماغية تقليل شدة السكتة الدماغية وتحسين البقاء على قيد الحياة بالمقارنة مع الفئران التي لم يتم علاجها من السكتات الدماغية.
والأكثر إثارة للدهشة هو أن L6-F4-2 يبدو أنه يعكس تسرب الأوعية الدموية في الدماغ بعد السكتة الدماغية الناجمة عن انسداد الأوعية الدموية.
يعمل الفريق الآن على تحديد ما إذا كان يمكن استخدام L6-F4-2، أو جزيء مماثل، لتطوير عقاقير يمكن اختبارها في البشر في المستقبل.
يقول كالفن كو: “نأمل أن يكون هذا خطوة أولى نحو تطوير جيل جديد من العقاقير التي يمكنها إصلاح الحاجز الدموي الدماغي، باستخدام استراتيجية وهدف جزيء مختلفة تمامًا عن الأدوية الحالية”.
تم نشر البحث في مجلة Nature Communications.
المصدر: تجمع الاطباء الفلسطينيين المستقلين